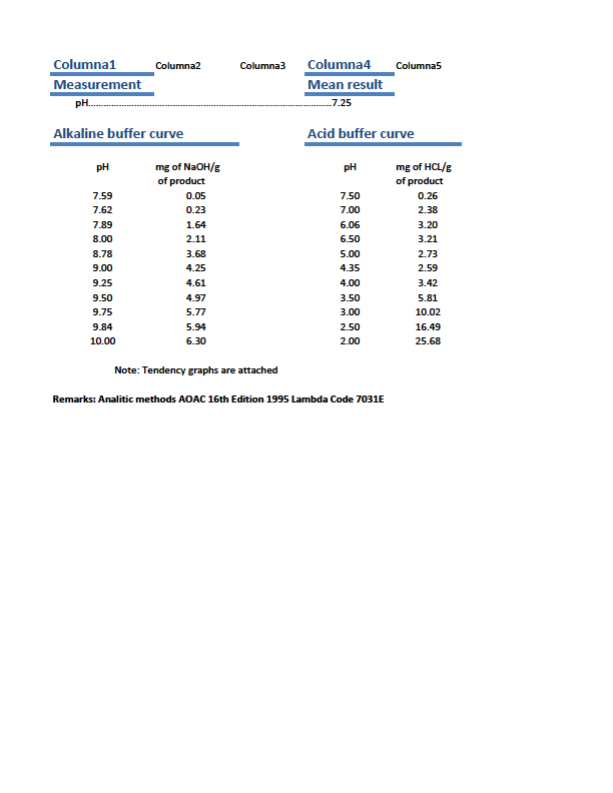
Cubrisoft y Dynactil en cicatrización
DYNACTIL
Cicatrizante
Contenido
Concepto de microambiente tisular 3
Control redox a nivel tisular 6
Resolución de la inflamación y anti-nocicepción 10
Resolución de la inflamación y combate a la infección 12
Acrónimos
ADN:Ácido deoxiribonucléico 2
ATPase: enzimas que catalizan la descomposición de ATP en ADP 2
AT-RvD1:Resolvina D1 estimulada por aspirina 12
CD154:marcador inmunoespecífico de células colaboradoras en infección por citomégalo virus
células NK:Linfocitos asesinos naturales 5
ECM:Matriz extracelular 5
ERK:Cinasa extracelular regulada por señalización 12
H2O2:Peróxido de hidrógeno 3
HaCaT:queratinocito anapleuroide inmortal 3
HLA:Presentador de antígenos a leucocitos colaboradores 5
IgE:Inmunoglobulina E 4
IgM:Inmunoglobulina M 4
IL12:interleucina IL12 4
IL18:interleucina LI18 4
IL-1β:Interleucina 1 β 12
ILCs: células linfocitarias residentes 4
linfocitos T-CD4+:linfocitos colaboradores 4
LXA4:Lipoxina A4 15
mV:milivolt 2
NADPH:Dinucleotido fosfato adeninicotinamida oxidasa 6
nM:nanoMol 15
PTE: potencial transepitelial 2
PTM: potencial transmembrana 2
receptor BLT1:Receptor de leucotrieno B1 15
receptor NKG2C:Receptor transmembranoso con terminal-C y dominio tipo lectina tipo C 5
receptores TLR:Receptores de tipo Toll 4
Rho:Hexámero protéico que fungen en la terminación alternativa de la transcripción 6
RvD1:Resolvina D1 12
RvE1:Resolvina E1 12
señalización YAP/TAZ: Proteínas que están relacionados 6
TGF-β:Factor de crecimiento transformante beta 14
TNF-α:Factor de necrosis tumoral α 12
μA:microamperio 2
Introducción y Antecedentes
Método biomédico de estabilización del pH, del balance redox microambiental y del espectro de los campos eléctricos endógenos a nivel tisular para obtener óptima cicatrización, alivio periférico del dolor y control de la infección.
Los campos eléctricos endógenos modulan los procesos morfogenéticos, el crecimiento y los comportamientos celulares e influyen sobre la vitalidad de los microabientes internos, el favorecimiento del flujo transcelular de información externa hacia el nuclear y la supervivencia celular (estabilidad del poro de transición de permeabilidad mitocondrial).
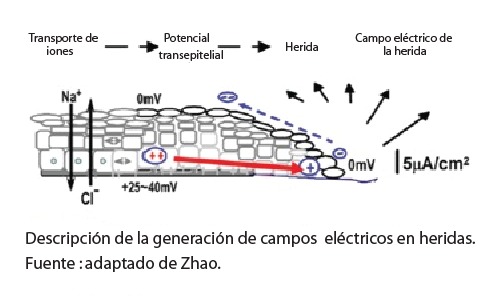
En la piel, los campos endógenos se mantienen por un flujo de iones en el medio intraepidérmico (bombas de Na+/K+ ATPase y su segregación) que genera un potencial transmembrana (PTM) a nivel celular y una señal bio-eléctrica que permite a las células: a) transportar moléculas alrededor de la membrana y hacia el interno de la célula, b) señalizar los eventos ocurridos en la superficie o fuera del medio y c) a enviar señales a larga distancia en ambas vías. Por el espesor de la contextura el intercambio intraepidérmico se desenvuelve con asimetría, lo que genera un PTE (potencial transepitelial) en un rango de +20 a +50 mV, a nivel de la membrana basal en la dermis y de 0 mV, en la superficie del estrato córneo. El potencial ha sido también llamado batería cutánea1.
Ante la presencia de agresiones que afecten la integridad de la piel como tejido biológico, este adquiere características de material dieléctrico. Los cambios en la membrana celular alteran el PTM y PTE, generándose un corto circuito. Dicho potencial genera en la lesión características eléctricas específicas y una menor resistencia en comparación con el tejido íntegro y da lugar a una salida de corriente de entre 1 y 10 μA/cm2 y una densidad de corriente estimada en 300 μA/cm2 cerca del borde de la herida. La herida se torna más negativa hacia el centro y hasta colapsar a 0mV2.
En el borde de la herida se mantiene un gradiente de voltaje mayor a 200 mV/mm y una corriente entre 1 y 1,5 mA/mm (por milímetro de circunferencia de la herida), la cual fluye y se escapa a través del circuito creado, llegando a las capas subepidérmicas. Pero el potencial dérmico permanece intacto en una distancia de 2 a 3 mm alrededor del borde de la herida y genera una corriente lateral direccionada centrípetamente. Se induce entonces migración celular del tejido periférico desde ambos lados que tiende a encontrarse en el centro de la brecha para colmarla 2.
Como respuesta a la alteración en los campos eléctricos, se establece una incitación al cierre epitelial y a formar el epitelio de herida. El PTE sube a 100-150mV/mm e induce galvanotaxia de los queratinocitos. Dicho potencial no se conduce mediante electrones libres y por tanto no es difusible a través de medios solubles, o es decir humoralmente, y más bien, por estar alimentado con base en la carga eléctrica de iones, se difunde a través de la trama del tejido mismo y perdura hasta el cierre de la lesión 3. PTMs pueden acoplarse como primerísima señalización en una onda coherente de información que se difunde mediante las zonula adherens4 y túneles de nanotúbulos colaborantes5 y que pueden mover electroforéticamente a la serotonina, acoplarse a Ca++ para señalizar , a la fosfatasa supresora de tumor y homóloga de tensina (PTEN) o la misma maquinaria modificadora de la cromatina6.
Ha sido muy tentador pensar con base en lo anterior, que la estimulación eléctrica exógena acelera la cicatrización y esa intervención la han propuesto varios investigadores 2. Pero si bien las propuestas al respecto ya han existido por varias décadas y ha salido de esas posturas evidencia mecanística y alguna basada en resultados, no se ha logrado reunir evidencia concluyente clara a favor de establecerse como práctica clínica y principalmente por la limitada estandarización en los procedimientos de aplicación7.
Evidencia de respuesta tisular a cambios redox la ha aportado Banerjee7, con un estudio sobre el potencial eléctrico que entrega en una herida mediante un apósito tipo batería que contiene una pareja redox Ag/Zn. Los efectos biológicos fueron cuantificables in vitro, en células HaCaT y queratinocitos expuestos a los potenciales y pudieron equipararse a los de estimulación externa con aparatos eléctricos: valores máximos de (2.7 V/cm para Δϕ = 0.2 V y 13.5 V/cm para Δϕ = 1 V) y que son detectables en la superficie del apósito. Los queratinocitos migraron con mayor rapidez, aumentaron su producción de H2O2 y en las células HaCaT hubo elevación del potencial de membrana mitocondrial (Δψm). Un aumento de demanda energética de las células fue reflejado por más del doble de consumo de glucosa en 24 h, en comparación con el placebo; lo que hace pensar que estas células recurren a la glicolisis aeróbica para satisfacer la demanda de generar el epitelio de herida con suficiente velocidad. Los efectos descritos desaparecieron cuando la pareja redox Ag/Zn fue remplazada por simplemente Ag y Zn7.
Para fines prácticos de uso, Banerjee7 determinó que la separación de contacto del apósito en solo 0.55mm disminuye un 50% el potencial y 0.25mm de separación, disminuye un 50% su magnitud.
Con Dynactil se propone la simple estabilización de 3 factores, en vez que la estimulación exógena de solo uno y con entrega en forma de lipogel, en contacto íntimo con el tejido.
Concepto de microambiente tisular
Si además de manejar el factor eléctrico en cicatrización, se introduce el control sobre otros factores, como el control de pH y el equilibrio redox del tejido (define el fenotipo según sección Concepto microambiente tisular)8, hay buenas probabilidades de obtener una marcada acción cicatrizante mediante la simple estabilización de los mismos. Son tres fuerzas primordiales y principales, entre los otros factores que equilibran el microambiente celular y su entorno (humorales, neuroendócrinos, metabólicos, paracrinos, físicos y estructurales9, e inmunitarios10), y que mantienen la vigencia y homoestasis de los procesos vitales, así como la capacidad de montar una respuesta mediante reparación/resolución cuando se ocasiona disrupción de su integridad y sin efectos secundarios.
Además del conocido aparato de defensa innata mediante células hematopoiéticas y no-hematopiéticas, es de interés al respecto la dependencia en las células linfocitarias residentes (ILC1, ILC2, ILC3) para dar pronta y adicional respuesta inmunitaria al desequilibrio del microambiente y como factores locales, entran en juego mucho antes de la inmunidad adaptativa. La respuesta puede ser citotóxica por parte de células asesinas naturales (NK), o no-citotóxica, mediante secreción de citocínas locales como la IL12 y la IL18 (a cargo de células dendríticas, monocitos, eosinófilos y basófilos), lo que induce la secreción de interferón-ƴ y TNF por parte de ILCs, su autorenovación, interacción con linfocitos T-CD4+ y en algunos casos inclusive migración a órganos linfoides y no linfoides, reminiscentes de defensa sistémica, pero sin producción de anticuerpos por carencia de receptores recombinados específicos a antígenos (a excepción de IgM). No obstante mediante otros mecanismos de expresión efectora que no requieren de imprimación11 y la expresión de linfotoxina (LT) por parte de las ILCs, participan en la regulación de la producción de IgA en la lámina propia por linfocitos B, en ratones y humanos12. O también en humanos mediante la inducción de CD154 en ILC2 circulantes por los receptores TLR de la inmunidad innata, se potencia la producción de IgE en linfocitos B13.
Por complementariedad y redundancia existente entre inmunidad innata y adaptativa es claro que, en primera línea está un aparato innato regulador de las condiciones microambientales pronto a dar respuesta y que se encarga de preservar la homeostasis tisular y de controlar la inflamación11. Como también es claro que el aparato responde a cualquier perturbación del microambiente10; como el hallazgo de un enriquecimiento de ILC2s en cercanía del borde de heridas cutáneas en vía de resolución lo denota14. Contrariamente a lo que se creyó por muchas décadas las células que han intervenido conservan memoria del evento15,16; células NK que expresan el receptor NKG2C se entrenan a responder a retos subsiguientes con mayor vigor (cito-toxicidad anticuerpo-dependiente y mayor secreción de IFN-ƴ) en pacientes con citomégalovirus (HCMV). Algunos las denominan células NK “adaptativas”, porque responden a péptidos de HCMV HLA-E cargados ‒al menos parcialmente‒ para activar el receptor, lo que les confiere característica clonal-simil, propia de linfocitos B y T inmuno-específicos17.
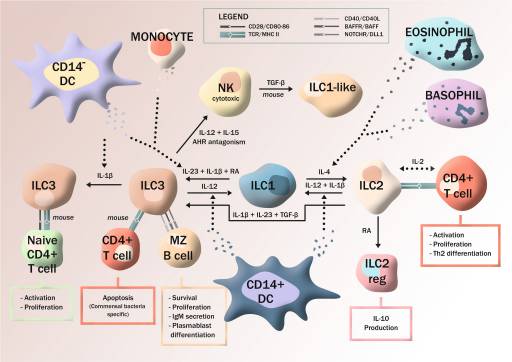
Inmunidad innata tisular no-citotóxica10.
Desde hace casi 4 décadas, ha salido a relucir la reciprocidad dinámica que existe entre los componentes del microambiente y núcleo18, el cual se expresa también de acuerdo a modificaciones epigenéticas. Más recientemente se ha observado que esta reciprocidad también está sujeta a la influencia de los radicales libres sistémicos o a los que localmente se generan (cambios redox), hecho que en parte controla la comunicación entre ECM y núcleo, y puede apreciarse según los conceptos que a continuación se exponen.
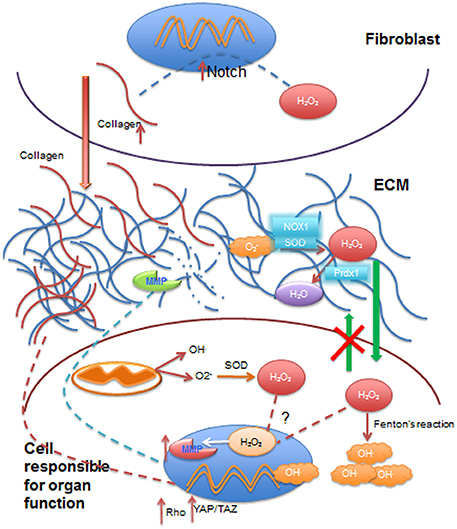
Efectos de los radicales libres en la ECM, citoplasma y el núcleo celular por reciprocidad dinámica.
Especies reactivas como el anión superóxido (O2−), ingresa a la matriz extracelular (ECM) proveniente de la circulación sanguínea y se convierte en peróxido de hidrógeno (H2O2) por acción de la dismutasa de superóxido (SOD) y las oxidasas NADPH y (NOX1) de la ECM. H2O2 puede ser reducido a agua (H2O) mediante reductasas como la peroxireductasa (Prdx1) de la ECM. El H2O2 extracelular puede difundirse a través de la membrana celular al citoplasma, pero no puede egresar de las células (flechas verdes), donde contribuye a aumentar los radicales libres intracelulares por producción del radical hidroxilo (OH.) mediante la reacción de Fenton, o puede ser transportado al núcleo para activar la transcripción de la metaloproteinasas (MMP) que en condiciones normales mantienen el colágeno equilibrado en la (ECM). La actividad mitocondrial contribuye a mantener los radicales libres intracelulares y enviar H2O2 a que ingrese en el núcleo celular. Células del estroma como los fibroblastos se activan con los radicales libres (principalmente H2O2), lo que aumenta la deposición de colágeno I en la ECM (flecha roja) vía Notch que conduce a aumento de la rigidez de la ECM y que a su vez activa señales de mecanotransducción, tales como Rho y a la señalización YAP/TAZ que llega a impactar la expresión de los genes8. Núcleos representados en azul y mitocondrias en color naranja.
En el año 2017 el mismo grupo del Berkeley Laboratories que propuso la Reciprocidad Dinámica, logró hallar mediante la integración de técnicas criogénicas, microscopía electrónica por volumen, microscopía de luz de super-resolución y cultivo tridimesional de células, finas conexiones citoesqueléticas entre la membrana citoplasmática, los sitios de anclaje celular, y la envoltura del núcleo y sus invaginaciones, de citofilamentos con terminaciones ricas en complejos LINC (ligador de nucleo y citoesqueleto) conocidos por su afinidad a la cromatina. La accesibilidad y nexos de los anclajes celulares hacia la ECM hacen entrever que existe conexión mecánica entre ECM y núcleo, quedando solamente por esclarecer el aspecto funcional de dicho ligamen19. Por tanto el concepto de microambiente tisular y la reciprocidad que existe entre sus componentes está hoy día muy bien caracterizado. Por ende la lógica de la propuesta de estabilizar el microambiente en 3 de sus variables, se fundamenta sobre evidencia de punta.
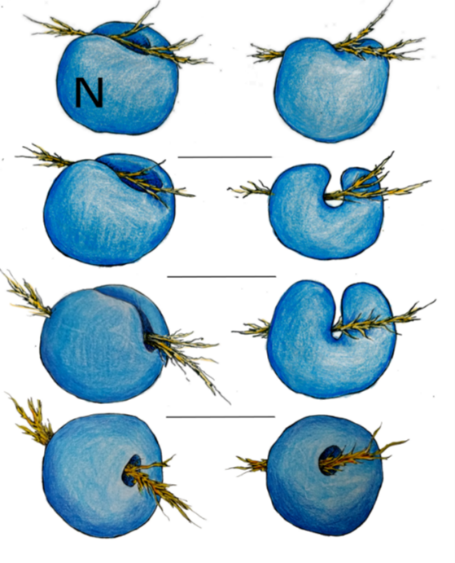 19
19
Diseños artísticos sobre las invaginaciones citoesqueléticas (actina) en el núcleo.
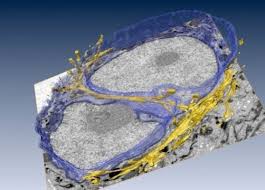 19
19
Control redox a nivel tisular
De los tres factores, el balance redox microambiental es fundamental para un buen resultado en cicatrización. Los métodos que emplean aplicación de plasma frío20 directamente en los tejidos han esclarecido los aspectos de los cuales se benefician heridas cutáneas para mantener un ambiente redox balanceado. Los plasmas fríos son fuente significativa de especies altamente oxidantes (ROS) como el ozono (O3), radical hidroxílico (OH-), superóxido O2-, el oxígeno solitario (1O2), como también las especies reactivas de nitrógeno (RNS) como el óxido nítrico (NO), peroxinitrito (ONOO-) peroxynitrite (ONOO−) y dióxido de nitrógeno NO2- 21. Algunos de estos elementos reactivos son considerados como segundos mensanjeros22.
Cambios en el equilibrio redox en las heridas disparan una respuesta coordinada de factores transcripcionales redox-sensitivos23. El factor nuclear eritroide 2-relacionado 2(NFR2), un zíper básico de leucina (bZIP) es un traductor para la señalización de defensa contra desbalances de la homeostasis redox y que dota a las células de capacidad de defensa antixodante y en bajar el estrés celular. En queratinocitos activa los senderos celulares de rescate contra el daño de especies reactivas, la inflamación, la apoptosis y regula los genes que codifican las enzimas detoxificantes y a las proteínas no enzimáticas, con poder similar 24. En condiciones de homeostasis, Nrf2 está asociado con una proteína que se liga a la actina, Kelch-simil proteina ECH-asociada 1(Keap1) factor vital en la cascada de señalización Nrf2, y que retiene a Nrf2 en el citoplasma marcado para degradación mediada por ubicuitina25. Cuando Nrf2 se libera de Keap1, por oxidación de cisteína afín a oxidación 151, 273 y 28826, viene transportado al núcleo donde se liga a sitios de reconocimiento de DNA, o elementos de respuesta antioxidante (AREs) en la región de promotores de genes diana, y se activa su transcipción27. La importancia deNrf2 para la función, protección y reparación de la piel está ampliamente documentado24.
En su mayoría las células cutáneas están equipadas para responder a la ola oxidante de reparación con enzimas antioxidantes, como la heme oxigenasa 1 (HMOX-1), NADPH quinona oxireductasa 1 (NQO1), glutatión Antioxidante 2018, 7, 146 5 de 7 S tranferasa (GST), citocroma P450, ƴ-glutamilcisteina ligasa catalítica (GCLC) y modificador subunidad (GCLM), dismutasa de superóxido 1-3 (SOD1-3), glutatión reductasa (GSR), tioredoxín reductasa (TRxR), tioredoxín (TXN), catalasa (CAT), glutatión peroxidasa (GPx) y antioxidantes no enzimáticos como glutatión, tioredoxín y ferritina24. El estímulo generado por las especies reactivas a los plasmas fríos se tradujo, por vía de la señalización redox Nrf2 sensitiva, a la activación de las dianas Nrf2-ARE y con expresión de GPx, CAT, SODs, HMOX1, y en la puesta en marcha de una marcada defensa antioxidante20. La producción de ROS se eleva en ratones HMOX1 knockout28 demostrando la alta capacidad de la enzima en metabolizar altos niveles de productos intermedios oxidantes. En un modelo in vivo de cicatrización se obtuvo una respuesta fisiológica acelerada del proceso al haber activado el Nrf229. El favorecimiento de la cicatrización in vivo de heridas con aplicación de plasma frío en ratas, ha sido también demostrado30,31,32. En otros modelos de cicatrización in vivo, la activación de Nrf2 favoreció el cierre de la herida en ratones diabéticos33,34.
Los factores. de pH y de estabilización de campos eléctricos endógenos por parte de Dynactil está a cargo del doble búfer de fosfatos propietario que maneja sea la concentración ácido/alcalina que el mantenimiento de un ambiente ligeramente oxidante redox. Su alta conductancia de 88.76 mS/cm es ideal para estabilizar los campos endógenos. A la calorimetría diferencial muestra 2 marcados eventos endotérmicos a 178°C y 211°C y la probabilidad de ser un sistema binario (UNA, 2006).
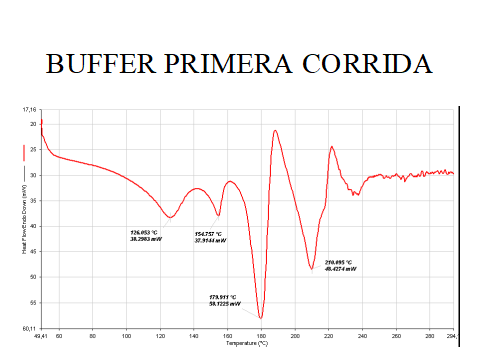
Resolución de la inflamación y anti-nocicepción
Si en el manejo de la cicatrización se logra que el proceso vire a la fase de resolución, los mediadores pro-resolutorios especializados (SPMs por su sigla en inglés) que la gobiernan desatan una intensa ola calmante del dolor.
Comúnmente el daño tisular conduce a la hiperactividad de nociceptores y a la secreción aumentada de neurotransmisores (glutamato) y neuromoduladores [sustancia P y el factor neurotrófico derivado del cerebro (BDnF)] en los centros de nocicepción de la médula espinal, que causa hiperactividad posináptica en las neuronas del cuerno dorsal (sensibilización central). La aumentada trasmisión sináptica reduce el umbral del dolor y a la amplificación de las respuestas hacia el dolor y de su persistencia, con diseminación del aumento de sensibilidad a áreas que se encuentran privas de daño tisular35,36.
La fosforilización de la Cinasa Regulada por Señalización Extracelular (pERK), miembro de la familia Cinasas de Proteína Activadas por Mitógenos (MAPK) y presente en las neuronas del cuerno dorsal, responde específicamente a estímulos nociceptivos y ‒tanto que‒ es utilizada como marcadora específica de sensibilización central35. La pERK juega un papel primordial en la inducción y mantenimiento de la sensibilización central al aumentar la actividad del receptor N-metil-D-aspartato (NMDA), el cual inhibe la actividad de los canales de potasio Kv4.237, que a su vez activa el receptor del Ácido α-amino-3-hidroxi-5-metilo-4-isoxazolpropiónico (AMPA) ‒específica al glutamato‒ e induce la transcripción de genes nociceptivos38. Más recientemente se ha logrado señalar la importancia de las células gliales, sea microglia que astrocitos, en el cerebro y la médula espinal en generar la sensibilización central ligada a la inflamación y el dolor posoperatorio39. Se produce esta mediante el TNF-α y la IL-1β, que inducen excitación y al mismo tiempo disminución de la inhibición de las neuronas del cuerno dorsal40. Adicionalmente, la facilitación descendiente cortical o desde el mismo encéfalo, o la merma en la función inhibidora en el cuerno dorsal por parte de las interneuronas inhibidoras41, puede aumentar y perseverar el dolor ante la presencia de daño tisular 42.
Con el descubrimiento de la fase de resolución de la inflamación, emergió la identificación en primera instancia de los receptores específicos a la resolvina RvE1 ‒tipo GPCR (receptores acoplados a la proteinaG=Gαi asociado Chem23)‒ en células de la inmunidad innata, en células dendríticas y microglía. Pero más recientemente, los receptores Chem23 han sido identificados en neuronas primarias sensoriales de los ganglios medulares dorsales (DRG). Sintetizados en los nódulos celulares de los DRGs son transportados axonalmente a terminales centrales y periféricas. También se expresan en neuronas de la médula dorsal. La inflamación que deriva de daño tisular activa además la expresión de Chem23 en macrófagos de la piel.
Cuando la inflamación se orienta hacia la fase de resolución, se desata la susodicha acción diferenciada calmante del dolor a cargo de la familia de las resolvinas, dirigida a contrarrestar la nocicepción que se establece por daño tisular. Se conoce de la RvE1 su efecto de bloquear el dolor espontáneo inducido por capsaicina, de la activación de la ERK en neuronas DRG, y de la plasticidad en las sinapsis de la médula espinal; pero sin afectar el dolor inducido por los receptores de potencial transitorio TRPA143. En contraste, RvD1 inhibe al TRPA1, TRPV3 y TRPV4, pero no al TRPV1; en cultivo de células embrionarias humanas de riñón 293 (HEK293) y de neuronas DRG44. En concordancia con estos hallazgos, la RvE1 es efectiva a dosis bajas en reducir la hiperalgesia por activación del TRPV143, mientras que la RvD1 y la AT-RvD1 son muy eficaces en inhibir la hiperalgesia mecánica, donde se involucran los receptores TRPA1/TRPV445. La RvE1 puede amortiguar también la alodinia mecánica inducida por adjuvante de Freund, pero esto ocurre a dosis mucho más altas que en la inhibición de la hiperalgesia por calor43. Recientemente un estudio demostró que la 17(R)-RvD1, un análogo de la RvD1, inhibió específicamente in vitro al TRPV3 46. De manera que, diferentes resolvinas regulan modalidades diferentes de dolor controlados por los TRPs.
La plasticidad sináptica en la medula espinal (i.e. sensibilización central) inducida por daño tisular periférico ha sido identificada como causa de dolor persistente posoperatorio. Esta se cuantifica en parte por cambios de las corrientes de excitación espontánea posináptica (sEPSCs), las cuales constan de mecanismos tanto presinápticos (cambios en frecuencia) como posinápticos (cambios de amplitud). Si bien la perfusión de secciones de medula espinal con RvE1 no altera la trasmisión sináptica basal, en cambio sí elimina los cambios de frecuencia inducidos en las sEPSCs por capsaicina y los aumentos inducidos por TNFα neuronas de la lámina II43. Lo anterior indica que la RvE1 puede normalizar la plasticidad sináptica de la medula espinal, presumiblemente inhibiendo la fosforilización de la ERK y aumento en secreción de glutamato en las terminales presinápticas43.
En la sensibilización central y dolor crónico es clave la activación de los receptores NMDA (N-metil-D-aspartato), los cuales responden a glutamato. El aumento del factor nuclear de necrosis tumoral alfa (TNFα) en la inflamación, no solamente aumenta la frecuencia de las sEPSCs, pero también de las corrientes inducidas por NMDA en neuronas del cuerno dorsal y en dependencia de la ERK (extracellular-signal-regulated kinase)43. Notablemente la RvE1 bloquea sea la fosforilización de la ERK que la inducida por el TNF-α, como también la activación correlacionada del receptor NMDA, en neuronas del cuerno dorsal47. Por lo que es concebible que la RvE1 abroga la sensibilización central mediante mecanismos presinápticos que posinápticos43. Otros eventos tendientes hacia el giro fibrótico en cicatrización ‒ligados al estrés oxidante‒ como lo son las transiciones endotelio-mesenquimatosas, se revierten por la acción de la AT-RvD1 y por la correlativa expresión de Nrf2 y el aumento de actividad de Smad7 48.
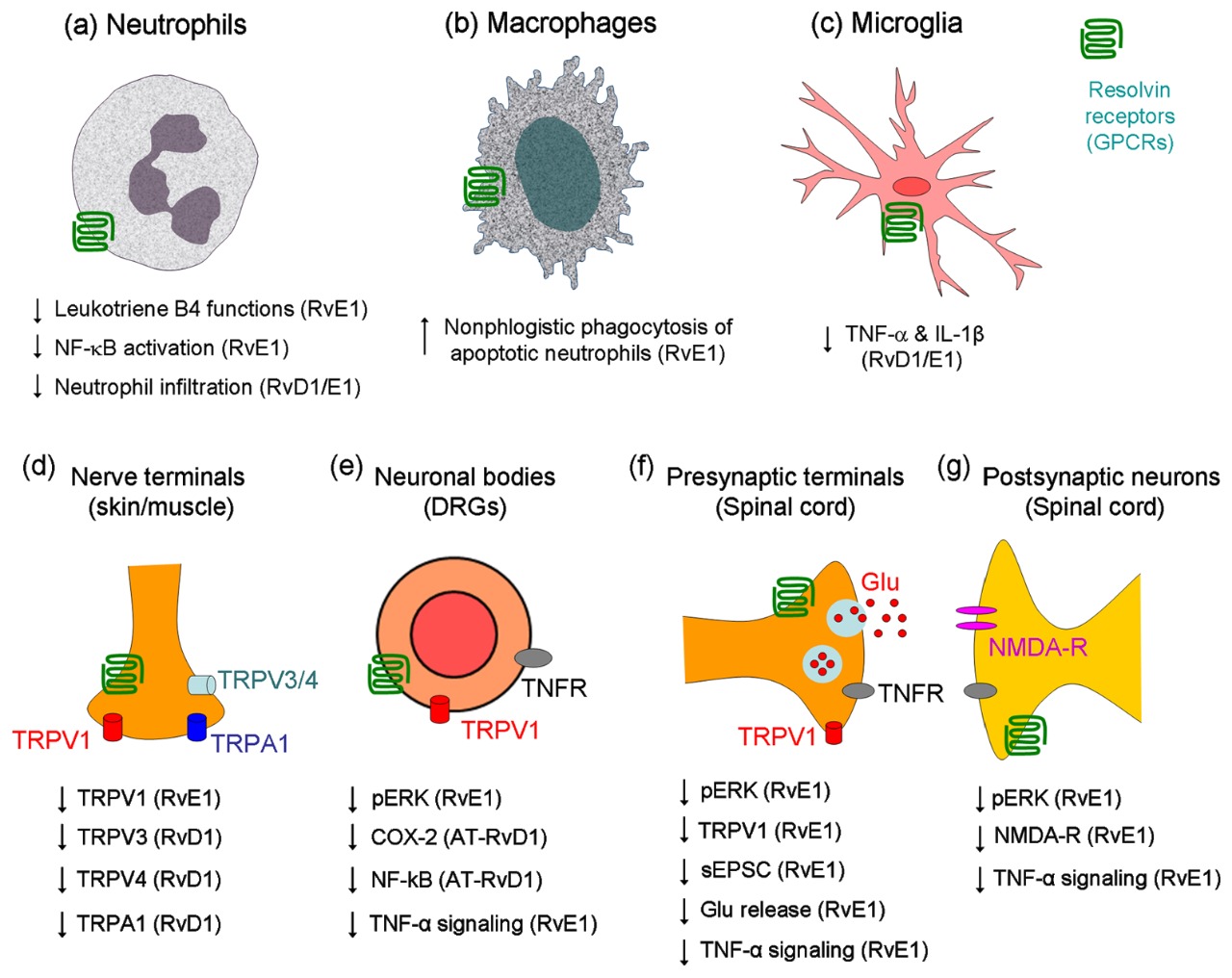
Receptores a las resolvinas40.
Resolución de la inflamación y combate a la infección
Cuando el proceso se ha enrumbado hacia finiquitar a la inflamación y a completar la resolución, la mediación de los SPMs influye también en el fortalecimiento de la defensa inmunitaria tisular que mantener a los tejidos libres de infección. Hay diferentes tipos de inmunoresolventes que intervienen durante el proceso y los eventos tempranos que ocurren inmediatamente después del reconocimiento del patógeno por el sistema inmune en su presencia, ejercen fuerte influencia sobre el desenlace.
Viraje hacia la autolimitación del proceso infeccioso se inicia en concomitancia de aumentos de la RvD5 y la PD1 (protectina); el cual induce la reducción de neutrófilos en el sitio de infección49. La respuesta no obstante es compleja cuando está en juego mantener el talante resolutorio e involucra al sistema nervioso. Se ha demostrado que el nervio vago interviene en la formación de los inmunoresolventes tipo Conjugado de Protectina para Regeneración de Tejido (PCRT)1 (ácido 16R-glutationoil, 17S-hidroxi-4Z,7Z,10Z-12E,14E,19Z-docosahexaenoico) mediante estímulo a células linfoides innatas tipo 3 (ILC-3), acción que eventualmente regula la respuesta de los macrófagos peritoneales a limpiar las infecciones bacterianas y a aplacar la acción de la citocinas pro-inflamatorias incluyendo el TNF-α y la IL-8, así como la producción de moléculas regenerativas; TGF-β inclusive50. La disrupción del reflejo del nervio vago altera la formación y el fenotipo de los macrófagos, lo cual en vez conduce a una resolución inflamatoria torpe y tardía 50.
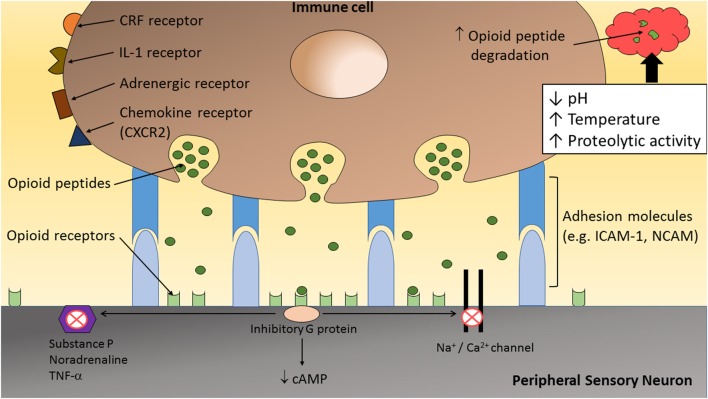
Microambiente neuro-inmune durante la inflamación51
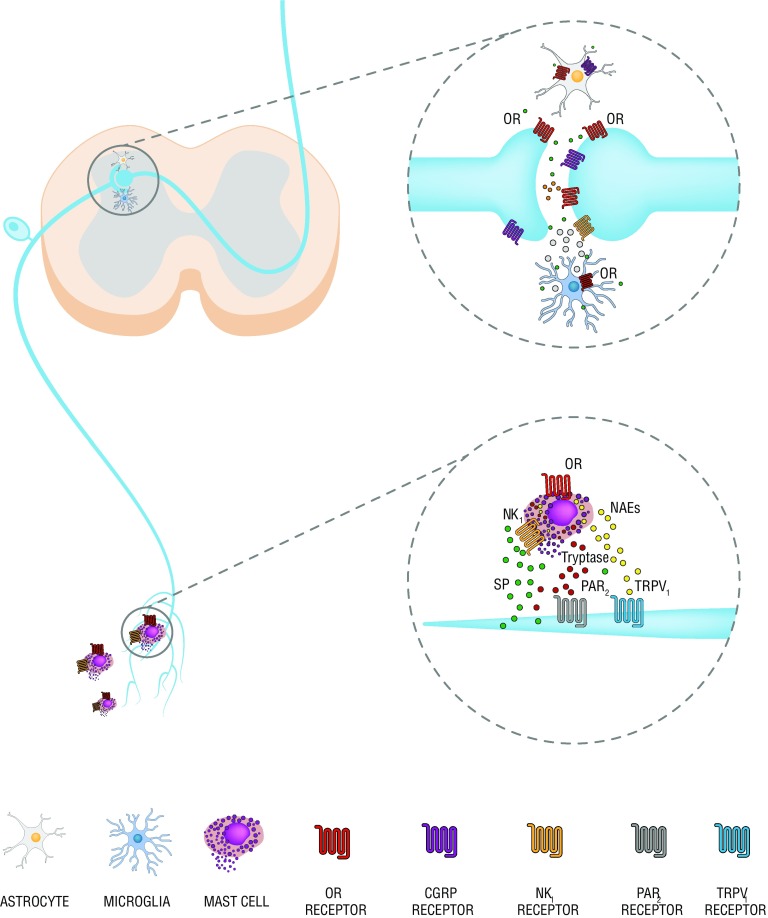
Los receptores opioides se expresan además que en las neuronas en células no-neurona. La de estas se alteran en el tratamiento de opioides crónico. La activación y sobre-regulación que se produce en los mastocitos del aparato períférico y en microglía y astroglía de médula espinal exacerba la inflamación mediante la producción de citocinas y quimiocinas pro-inflamatorias. Varrassi
En las últimas 2 décadas se ha demostrado además que existe una relación íntima entre sistema inmune y sistema nervioso periférico que se puede tildar como de interdependencia, durante el curso de sucesos inflamatorios. El sistema nervioso contribuye con activación de receptores localizados en las terminaciones sensoriales periféricas (aumento de expresión) y que se activan mediante péptidos opioides endógenos (beta-endorfinas, met- y leu-encefalinas, y dinorfina) expresados en las células inmunes del microambiente inflamatorio, con el fin de producir analgesia periférica. Se ha debatido extensamente sobre la existencia de verdaderas sinapsis neuro-inmunes, como se representa en la imagen, pero sin lugar a dudas se ha demostrado la existencia de la interrelación y que la acción es bloqueada por antagonistas opiodes51. Las observaciones sobre la longitud de las debatidas sinapsis son relevantes, en cuanto se han señalado ser de 6 nm, en contraste con las zonulas adherens de 2nm y las sinapsis nerviosas de 20nm. Muchas de las terminaciones se adentran en linfocitos y las membranas apuestas se muestran prominentes y engrosadas, sugiriendo transmisión bilateral y química, con activación postsináptica de los receptores52. La proximidad entre los componentes es sugerente de una acción analgésica notoria. Es claro también que, bajo el concepto de microambiente, las condiciones mismas de la inflamación tienden a debilitar (proteolisis) el efecto favorecedor citado y la propuesta de control del microambiente, para dominar la inflamación cobra lógica.
Sigue otra etapa en que son importantes la presencia de un grupo de lipo-péptidos (sulfido-conjugado de ácido docosahexaenoíco) denominados Conjugados de Maresina para la Regeneración de Tejido (MCTRs) que estimulan la eliminación de bacterias por acción de fagocitos y promueven la regeneración de tejido53. Asimismo importante es una familia de 13 variantes de resolvinas RvT derivadas del ácido docosapentanoíco y denominadas, Resolvinas serie 1350.
Más tardíamente cuando el hospedero ha montado la respuesta que termina en la erradicación del patógeno invasor en el peritoneo, emerge la maresina (MaR1) como principal mediador en exudados de infecciones de Escherichia Coli. Adicionalmente a promover la barrida de células apoptóticas y bacterias, la MaR1 bloquea la actividad del leucotrieno LTB4, mediante acción parcial de agonista/antagonista a nivel del receptor BLT154.
Es elocuente como el modelo in vivo en ratones de ligadura cecal y su subsiguiente perforación, que en buena parte recapitula parámetros de infección polimicrobiana en el humano ‒emulando una primera fase hiperdinámica y una hipodinámica luego‒, con la administración de RvD2 o LXA4 se reduce la presencia de mediadores pro-inflamatorios en el plasma y exudado, incluyendo a citocinas, quimiocinas (IL-10 en especial), eicosanoides, la carga bacteriana sistémica, número de neutrófilos y se aumenta la supervivencia55,56.
Por el contrario, la falta de iniciación del proceso de formación de las moléculas protectoras arriba mencionadas en general, conlleva a un retraso o ausencia de la respuesta resolutoria. El barrido de la carga bacteriana se entorpece y se exacerba la formación de todo tipo de mediadores pro-inflamatorios con complicaciones de inflamación no resuelta.
Esta respuesta a nivel del peritoneo es observable similarmente en otros órganos/sistemas57,58,49,59,60. En modelos animales de infecciones dérmicas, la regulación de los SPMs es también similar. En la piel las resolvinas señalizan la disminución de neutrófilos en infecciones de Staphilococcus aureus, con presencia muy temprana de RvD1 y RvD2 para luego la RvD3 y RvD4 llegar a su máximo; inmediatamente antes de que se reduzcan los neutrófilos (~40%) y se intensifique la eferocitosis (51%) a cargo de fibroblastos dérmicos humanos57. La suministración exógena de RvD4, RvD1 y RvD3 en los modelos in vivo de piel, aumenta el influjo de macrófagos, disminuye la carga bacteriana del sitio y aumenta la eferocitosis49,57,61. En el caso de neutrófilos debilitados inmunológicamente como en el caso de quemaduras, estos son rehabilitados a dar la respuesta resolutoria hasta con dosis de RvD2 tan bajas como de 1nM61.
Conclusión
La evidencia acumulada soporta la utilización de medios no farmacológicos que tienden a estabilizar el microambiente tisular en sus aspectos de equilibrio ácido/base, de señalización redox y de sus campos endógenos para obtener óptima cicatrización, alivio periférico del dolor y control de la infección.
Referencias
1. Barker AT, Jaffe LF, Vanable JW. The glabrous epidermis of cavies contains a powerful battery. Am J Physiol. 1982;242(3):R358-66. doi:10.1152/ajpregu.1982.242.3.R358
2. Zhao M. Electrical fields in wound healing—An overriding signal that directs cell migration. Semin Cell Dev Biol. 2009;20(6):674-682. doi:10.1016/J.SEMCDB.2008.12.009
3. Hunckler J, de Mel A. A current affair: electrotherapy in wound healing. J Multidiscip Healthc. 2017;10:179-194. doi:10.2147/JMDH.S127207
4. McCaig CD, Song B, Rajnicek AM. Electrical dimensions in cell science. J Cell Sci. 2009;122(Pt 23):4267-4276. doi:10.1242/jcs.023564
5. Wang X, Veruki ML, Bukoreshtliev N V, Hartveit E, Gerdes H-H. Animal cells connected by nanotubes can be electrically coupled through interposed gap-junction channels. Proc Natl Acad Sci U S A. 2010;107(40):17194-17199. doi:10.1073/pnas.1006785107
6. Zhao M, Song B, Pu J, et al. Electrical signals control wound healing through phosphatidylinositol-3-OH kinase-γ and PTEN. Nature. 2006;442(7101):457-460. doi:10.1038/nature04925
7. Banerjee J, Das Ghatak P, Roy S, et al. Improvement of Human Keratinocyte Migration by a Redox Active Bioelectric Dressing. Mukhopadhyay P, ed. PLoS One. 2014;9(3):e89239. doi:10.1371/journal.pone.0089239
8. Chittiboyina S, Bai Y, Lelièvre SA. Microenvironment-Cell Nucleus Relationship in the Context of Oxidative Stress. Front Cell Dev Biol. 2018;6:23. doi:10.3389/fcell.2018.00023
9. Scadden DT. The stem-cell niche as an entity of action. Nature. 2006;441(7097):1075-1079. doi:10.1038/nature04957
10. Mazzurana L, Rao A, Van Acker A, Mjösberg J. The roles for innate lymphoid cells in the human immune system. Semin Immunopathol. 2018;40(4):407-419. doi:10.1007/s00281-018-0688-7
11. Gasteiger G, D’Osualdo A, Schubert DA, Weber A, Bruscia EM, Hartl D. Cellular Innate Immunity: An Old Game with New Players. J Innate Immun. 2017;9(2):111-125. doi:10.1159/000453397
12. Kruglov AA, Grivennikov SI, Kuprash D V., et al. Nonredundant Function of Soluble LT 3 Produced by Innate Lymphoid Cells in Intestinal Homeostasis. Science (80- ). 2013;342(6163):1243-1246. doi:10.1126/science.1243364
13. Maggi L, Montaini G, Mazzoni A, et al. Human circulating group 2 innate lymphoid cells can express CD154 and promote IgE production. J Allergy Clin Immunol. 2017;139(3):964-976.e4. doi:10.1016/j.jaci.2016.06.032
14. Rak GD, Osborne LC, Siracusa MC, et al. IL-33-Dependent Group 2 Innate Lymphoid Cells Promote Cutaneous Wound Healing. J Invest Dermatol. 2016;136(2):487-496. doi:10.1038/JID.2015.406
15. Netea MG, Joosten LAB, Latz E, et al. Trained immunity: A program of innate immune memory in health and disease. Science (80- ). 2016;352(6284):aaf1098-aaf1098. doi:10.1126/science.aaf1098
16. Pahl JHW, Cerwenka A, Ni J. Memory-Like NK Cells: Remembering a Previous Activation by Cytokines and NK Cell Receptors. Front Immunol. 2018;9:2796. doi:10.3389/fimmu.2018.02796
17. Rölle A, Meyer M, Calderazzo S, Jäger D, Momburg F. Distinct HLA-E Peptide Complexes Modify Antibody-Driven Effector Functions of Adaptive NK Cells. Cell Rep. 2018;24(8):1967-1976.e4. doi:10.1016/j.celrep.2018.07.069
18. Mina J. Bissell, H. Glenn Hall GP. How Does the Extracellular Matrix Direct Gene Expression ? J Theor Biol. 1982;Volume 99(Issue 1):31-68.
19. Jorgens DM, Inman JL, Wojcik M, et al. Deep nuclear invaginations are linked to cytoskeletal filaments – integrated bioimaging of epithelial cells in 3D culture. J Cell Sci. 2016;130(1):177-189. doi:10.1242/jcs.190967
20. Schmidt A, Bekeschus S. Redox for Repair: Cold Physical Plasmas and Nrf2 Signaling Promoting Wound Healing. Antioxidants. 2018;7(10):146. doi:10.3390/antiox7100146
21. Jablonowski H. Research on plasma medicine-relevant plasma–liquid interaction: What happened in the past five years? Clin Plasma Med. 2015;3(2):42-52. doi:10.1016/J.CPME.2015.11.003
22. Schieber M, Chandel NS. ROS function in redox signaling and oxidative stress. Curr Biol. 2014;24(10):R453-62. doi:10.1016/j.cub.2014.03.034
23. Jaiswal AK. Nrf2 signaling in coordinated activation of antioxidant gene expression. Free Radic Biol Med. 2004;36(10):1199-1207. doi:10.1016/J.FREERADBIOMED.2004.02.074
24. Schäfer M, Werner S. Nrf2—A regulator of keratinocyte redox signaling. Free Radic Biol Med. 2015;88:243-252. doi:10.1016/J.FREERADBIOMED.2015.04.018
25. Sun Z, Zhang S, Chan JY, Zhang DD. Keap1 controls postinduction repression of the Nrf2-mediated antioxidant response by escorting nuclear export of Nrf2. Mol Cell Biol. 2007;27(18):6334-6349. doi:10.1128/MCB.00630-07
26. Matzinger M, Fischhuber K, Heiss EH. Activation of Nrf2 signaling by natural products-can it alleviate diabetes? Biotechnol Adv. 2018;36(6):1738-1767. doi:10.1016/J.BIOTECHADV.2017.12.015
27. Nguyen T, Sherratt PJ, Nioi P, Yang CS, Pickett CB. Nrf2 controls constitutive and inducible expression of ARE-driven genes through a dynamic pathway involving nucleocytoplasmic shuttling by Keap1. J Biol Chem. 2005;280(37):32485-32492. doi:10.1074/jbc.M503074200
28. Matsumoto H, Ishikawa K, Itabe H, Maruyama Y. Carbon monoxide and bilirubin from heme oxygenase-1 suppresses reactive oxygen species generation and plasminogen activator inhibitor-1 induction. Mol Cell Biochem. 2006;291(1-2):21-28. doi:10.1007/s11010-006-9190-y
29. Arndt S, Schmidt A, Karrer S, von Woedtke T. Comparing two different plasma devices kINPen and Adtec SteriPlas regarding their molecular and cellular effects on wound healing. Clin Plasma Med. 2018;9:24-33. doi:10.1016/J.CPME.2018.01.002
30. Chatraie M, Torkaman G, Khani M, Salehi H, Shokri B. In vivo study of non-invasive effects of non-thermal plasma in pressure ulcer treatment. Sci Rep. 2018;8(1):5621. doi:10.1038/s41598-018-24049-z
31. Kubinova S, Zaviskova K, Uherkova L, et al. Non-thermal air plasma promotes the healing of acute skin wounds in rats. Sci Rep. 2017;7:45183. doi:10.1038/srep45183
32. Zhang J-P, Guo L, Chen Q-L, et al. Effects and mechanisms of cold atmospheric plasma on skin wound healing of rats. Contrib to Plasma Phys. 2019;59(1):92-101. doi:10.1002/ctpp.201800025
33. Rabbani PS, Zhou A, Borab ZM, et al. Novel lipoproteoplex delivers Keap1 siRNA based gene therapy to accelerate diabetic wound healing. Biomaterials. 2017;132:1-15. doi:10.1016/J.BIOMATERIALS.2017.04.001
34. Long M, Rojo de la Vega M, Wen Q, et al. An Essential Role of NRF2 in Diabetic Wound Healing. Diabetes. 2016;65(3):780-793. doi:10.2337/db15-0564
35. Ji R-R, Kohno T, Moore KA, Woolf CJ. Central sensitization and LTP: do pain and memory share similar mechanisms? Trends Neurosci. 2003;26(12):696-705. doi:10.1016/j.tins.2003.09.017
36. Dubner R, Ruda MA. Activity-dependent neuronal plasticity following tissue injury and inflammation. Trends Neurosci. 1992;15(3):96-103. doi:10.1016/0166-2236(92)90019-5
37. Diaz M, Retamal MA. Editorial: Modulation of Ion Channels and Ionic Pumps by Fatty Acids: Implications in Physiology and Pathology. Vol 9.; 2018. doi:10.3389/fphys.2018.01625
38. Latremoliere A, Woolf CJ. Central sensitization: a generator of pain hypersensitivity by central neural plasticity. J Pain. 2009;10(9):895-926. doi:10.1016/j.jpain.2009.06.012
39. Palazzo E, Luongo L, Guida F, et al. Role of N-Acylethanolamines in the Neuroinflammation: Ultramicronized Palmitoylethanolamide in the Relief of Chronic Pain and Neurodegenerative Diseases. Neuropsychiatry (London). 2019;(1):2035-2046. doi:10.4172/Neuropsychiatry.1000549
40. Ji R-R, Xu Z-Z, Strichartz G, Serhan CN. Emerging roles of resolvins in the resolution of inflammation and pain. Trends Neurosci. 2011;34(11):599-609. doi:10.1016/j.tins.2011.08.005
41. von Hehn CA, Baron R, Woolf CJ. Deconstructing the neuropathic pain phenotype to reveal neural mechanisms. Neuron. 2012;73(4):638-652. doi:10.1016/j.neuron.2012.02.008
42. Ossipov MH, Dussor GO, Porreca F. Central modulation of pain. J Clin Invest. 2010;120(11):3779-3787. doi:10.1172/JCI43766
43. Xu Z-Z, Zhang L, Liu T, et al. Resolvins RvE1 and RvD1 attenuate inflammatory pain via central and peripheral actions. Nat Med. 2010;16(5):592-597, 1p following 597. doi:10.1038/nm.2123
44. Bang S, Yoo S, Yang TJ, Cho H, Kim YG, Hwang SW. Resolvin D1 attenuates activation of sensory transient receptor potential channels leading to multiple anti-nociception. Br J Pharmacol. 2010;161(3):707-720. doi:10.1111/j.1476-5381.2010.00909.x
45. Alessandri-Haber N, Dina OA, Joseph EK, Reichling D, Levine JD. A Transient Receptor Potential Vanilloid 4-Dependent Mechanism of Hyperalgesia Is Engaged by Concerted Action of Inflammatory Mediators. J Neurosci. 2006;26(14):3864-3874. doi:10.1523/JNEUROSCI.5385-05.2006
46. Bang S, Yoo S, Yang TJ, Cho H, Hwang SW. 17(R)-resolvin D1 specifically inhibits transient receptor potential ion channel vanilloid 3 leading to peripheral antinociception. Br J Pharmacol. 2012;165(3):683-692. doi:10.1111/j.1476-5381.2011.01568.x
47. Kawasaki Y, Zhang L, Cheng J-K, Ji R-R. Cytokine mechanisms of central sensitization: distinct and overlapping role of interleukin-1beta, interleukin-6, and tumor necrosis factor-alpha in regulating synaptic and neuronal activity in the superficial spinal cord. J Neurosci. 2008;28(20):5189-5194. doi:10.1523/JNEUROSCI.3338-07.2008
48. Harrison JL, Rowe RK, Ellis TW, et al. Resolvins AT-D1 and E1 differentially impact functional outcome, post-traumatic sleep, and microglial activation following diffuse brain injury in the mouse. Brain Behav Immun. 2015;47:131-140. doi:10.1016/j.bbi.2015.01.001
49. Chiang N, Fredman G, Bäckhed F, et al. Infection regulates pro-resolving mediators that lower antibiotic requirements. Nature. 2012;484(7395):524-528. doi:10.1038/nature11042
50. Dalli J, Colas RA, Arnardottir H, Serhan CN. Vagal Regulation of Group 3 Innate Lymphoid Cells and the Immunoresolvent PCTR1 Controls Infection Resolution. Immunity. 2017;46(1):92-105. doi:10.1016/J.IMMUNI.2016.12.009
51. Hua S. Neuroimmune Interaction in the Regulation of Peripheral Opioid-Mediated Analgesia in Inflammation. Front Immunol. 2016;7:293. doi:10.3389/fimmu.2016.00293
52. Felten DL. Direct Innervation of Lymphoid Organs: Substrate for Neurotransmitter Signaling of Cells of the Immune System. Neuropsychobiology. 1993;28(1-2):110-112. doi:10.1159/000119011
53. Dalli J, Chiang N, Serhan CN. Identification of 14-series sulfido-conjugated mediators that promote resolution of infection and organ protection. Proc Natl Acad Sci U S A. 2014;111(44):E4753-61. doi:10.1073/pnas.1415006111
54. Colas RA, Dalli J, Chiang N, et al. Identification and Actions of the Maresin 1 Metabolome in Infectious Inflammation. J Immunol. 2016;197(11):4444-4452. doi:10.4049/jimmunol.1600837
55. Spite M, Norling L V., Summers L, et al. Resolvin D2 is a potent regulator of leukocytes and controls microbial sepsis. Nature. 2009;461(7268):1287-1291. doi:10.1038/nature08541
56. Wu B, Walker JA, Temmermand D, et al. Lipoxin A4 promotes more complete inflammation resolution in sepsis compared to stable lipoxin A4 analog. Prostaglandins, Leukot Essent Fat Acids. 2013;89(1):47-53. doi:10.1016/J.PLEFA.2013.04.005
57. Winkler JW, Orr SK, Dalli J, et al. Resolvin D4 stereoassignment and its novel actions in host protection and bacterial clearance. Sci Rep. 2016;6(1):18972. doi:10.1038/srep18972
58. Abdulnour RE, Sham HP, Douda DN, et al. Aspirin-triggered resolvin D1 is produced during self-resolving gram-negative bacterial pneumonia and regulates host immune responses for the resolution of lung inflammation. Mucosal Immunol. 2016;9(5):1278-1287. doi:10.1038/mi.2015.129
59. Ramon S, Dalli J, Sanger JM, et al. The Protectin PCTR1 Is Produced by Human M2 Macrophages and Enhances Resolution of Infectious Inflammation. Am J Pathol. 2016;186(4):962-973. doi:10.1016/J.AJPATH.2015.12.012
60. Dalli J et al. Does promoting resolution instead of inhibiting inflammation represent the new paradigm in treating infections? Mol Aspects Med. 2017;58:12-20. doi:10.1016/J.MAM.2017.03.007
61. Kurihara T, Jones CN, Yu Y-M, et al. Resolvin D2 restores neutrophil directionality and improves survival after burns. FASEB J. 2013;27(6):2270-2281. doi:10.1096/fj.12-219519